专注认证事业二十四年
ISO 13485标准是适用于医疗器械法规环境下的质量管理体系标准,其全称是《医疗器械质量管理体系 用于法规的要求》。它采用了基于ISO 9001标准中PDCA的相关理念,相较ISO 9001标准适用于所有类型的组织,ISO 13485更具有专业性,重点针对与医疗器械设计开发、生产、贮存和流通、安装、服务和最终停用及处置等相关行业的组织。目前组织可以依据ISO 13485:2016版标准建立体系或者寻求认证。
ISO13485:2016标准重点内容:
本标准以法规要求为主线,强化了企业满足法规要求的主体责任;
本标准强调基于风险的方法管理过程,强化组织应将基于风险的方法应用于控制质量管理体系所需的适当过程;
本标准重点强调与监管机构进行沟通和报告的要求;
本标准在ISO9001的基础上,更加强调形成文件的要求和记录的要求。
适用于:为进行医疗器械的设计和开发、生产、贮存和流通、安装、服务和最终停用及处置,以及相关活动(例如技术支持)设计和开发或提供的组织。或者申请组织也可为向这种组织提供产品(例如原材料、组件、部件、医疗器械、灭菌服务、校准服务、流通服务、维护服务)的供方或其他外部方。
GB/T 42061-2022/ISO 13485:2016《医疗器械 质量管理体系 用于法律的要求》
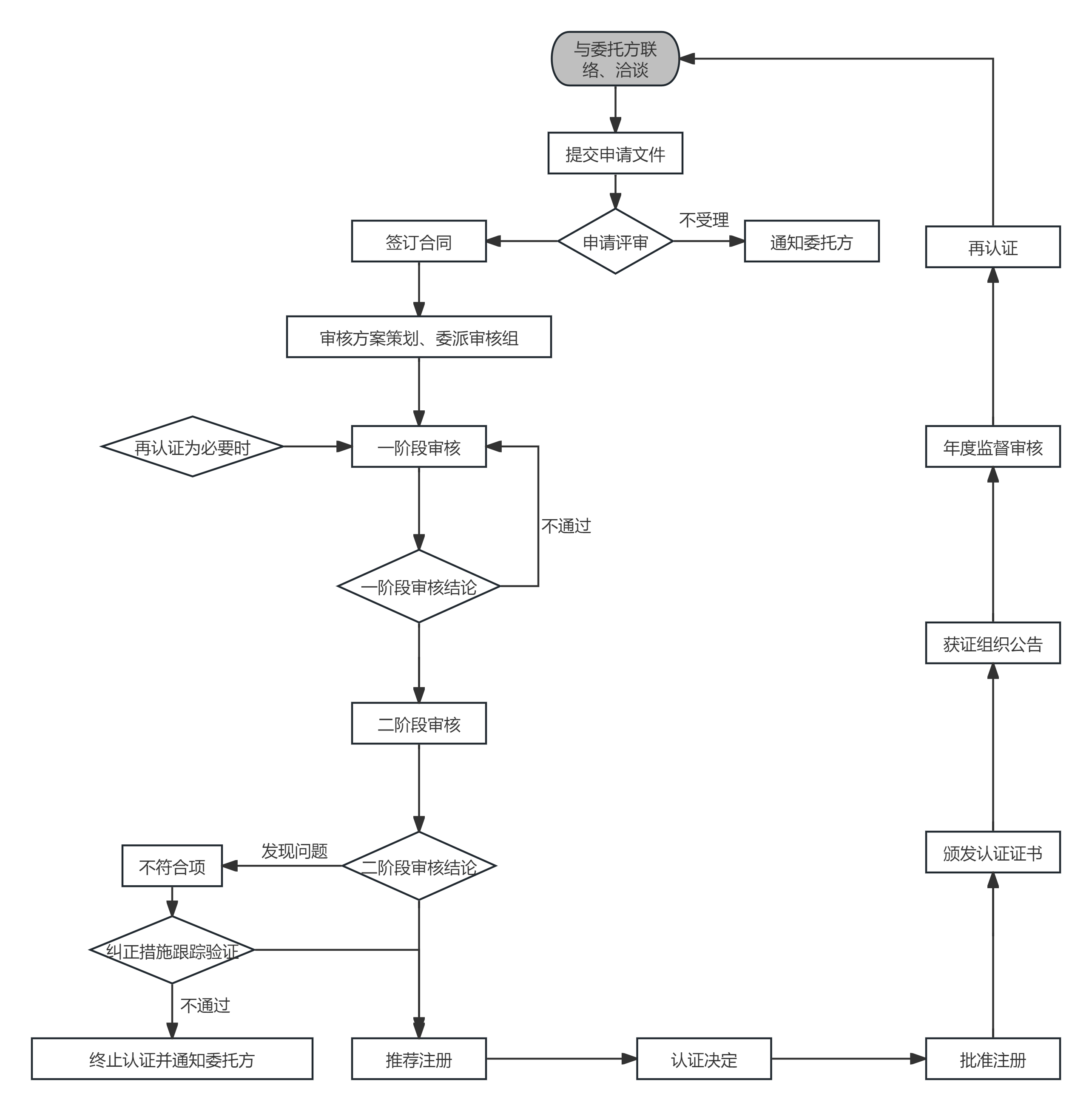
编号:NGV-GZ-MDQ-2020 《医疗器械管理体系认证规则》
发布单位:北京恩格威认证中心有限公司
上述认证规则归北京恩格威认证中心有限公司所有,北京恩格威认证中心有限公司对其拥有最终解释权。如需获取相关实施规则请与以下联系方式获取:
电话:010-87531381;010-87531396
邮箱:chenxj@ngv.org.cn;hexinran@ngv.org.cn